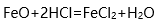某钢铁厂每天需消耗5000t含Fe2 O3 76%的赤铁矿石,该厂理论上可日产含Fe98%
的有关信息介绍如下:
首先写出赤铁矿转化为铁的化学方程哗扒谨式:2Fe2O3 = 4Fe+ 3O25000t矿石中76%的乱基Fe2O3自然就是5000*76%t了.设可制铁x吨。根据守衡规此握律:分子质量 2*160————4*56则质量 5000*76%——--x*98%上述数据关系为2*160*x*98%=5000*76%*4*56( 交叉相乘即相等)故x=2714.29这样的质量问题,只需要把方程式配平就很好办了
版权声明:文章由 好百科 整理收集,来源于互联网或者用户投稿,如有侵权,请联系我们,我们会立即处理。如转载请保留本文链接:https://www.haobaik.com/life/220965.html