为什么H2O是sp3杂化
的有关信息介绍如下:
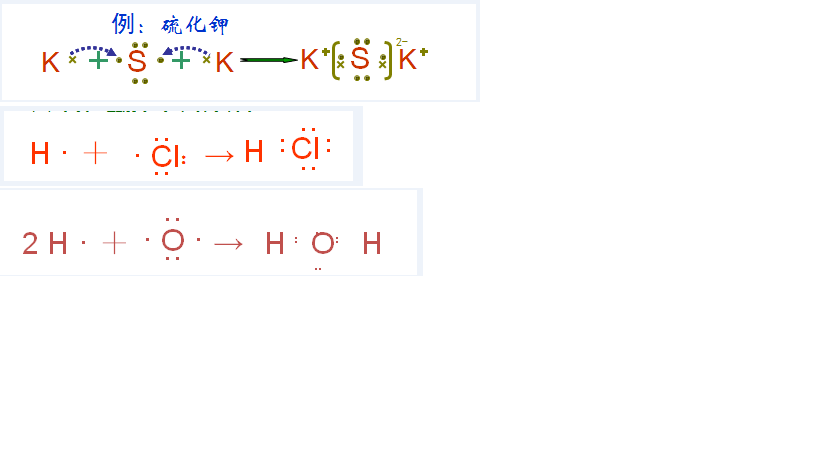
H2O:【H2O与NH3相似O-H之间的夹角为104.4极性分子】 为SP3杂化,H2O中的两对孤对电子与老举两个H呈四面体构型 由于孤对电子的排斥力比H的大,所呈的四面体并不是正面体,两个H占据四面体的两个顶点,O处在中心位置,H-O-H键角为104.5°,偏离理想正四面体109.47°.正负电荷中心并不重合. NH3:【NH3分子为三角锥形分子,是极性分子107°181′】。N原子以sp3杂化轨道成键,侍扰碧 氨气分子中只有三个氢原子,只成了三个键,仍然有一对孤电子对没有用,所以这对孤电子对 对其他三根键产生排斥李码作用,所以氨气的结构是三角锥型,键角是107°181′
版权声明:文章由 好百科 整理收集,来源于互联网或者用户投稿,如有侵权,请联系我们,我们会立即处理。如转载请保留本文链接:https://www.haobaik.com/tips/250745.html